| |
Основы генетики мозга
Нейроэволюция
Константин Владимирович Анохин - профессор, доктор медицинских наук, член-корреспондент РАМН, руководитель отдела системогенеза НИИ нормальной физиологии им. П.К.Анохина:
«Одна из интереснейших целей генетики и молекулярной биологии – загадка нейроэволюции. Я называю этим словом феномен, открытый в последние годы молекулярной генетикой. Простой, но поразительный факт: чтобы создать любой из наших внутренних органов, требуется всего три, пять, иногда семь процентов всех генов. А для создания мозга у человека и других млекопитающих предназначено более половины генов в составе генома. Задумайтесь: каждый второй из наших генов работает для обеспечения функций мозга. Это в корне меняет представления о содержании эволюции. Нежная ткань мозга не сохранялась у ископаемых животных, и палеонтологи более двух веков изучали в основном строение тела, скелета, черепов и костей. Но сегодня мы начинаем осознавать, что основные усилия эволюции мира животных были затрачены именно на создание мозга. Как гениально ощутил это более полувека назад Тейяр де Шарден: "История жизни есть, по существу, развитие сознания, завуалированное морфологией".
Представьте себе, что в один трагический день все компьютеры сгорели, остались только их механические части и внешняя оболочка. Цивилизация, пришедшая нам на смену, пытается восстановить, как они функционировали. Изучают оставшиеся корпуса, мониторы, дисководы. Но чтобы понять, что такое компьютер, нужно, прежде всего, восстановить центральные процессоры, их внутреннюю архитектуру и программы. Это как раз то, чем занимаются ученые, изучающие сегодня мозг на генетическом уровне. Какие гены работают в мозге? Что они делают? Почему их так много? Как они там появились? Как на путях такой биологической эволюции возникли разум и человеческий мозг?
Чтобы ответить на эти вопросы, необходима новая синтетическая теория. Она должна объединить общим языком молекулярной генетики три области биологии - изучение эмбрионального развития мозга, его работы при поведении и его изменений в эволюции.
Мы начали заниматься крохотной частью этих вопросов в середине 80-х годов, когда о молекулярной биологии мозга было мало что известно. Пытались обнаружить гены, ответственные за ключевые функции мозга - обучение и формирование памяти. В обычном состоянии мозга эти гены "молчат", но как только происходит что-то, что требует запоминания, они активируются, а потом, выполнив свою работу, вновь замолкают.
Нам посчастливилось найти такие гены, и мы сумели с их помощью научиться "выуживать" из многообразного, очень сложного процесса именно те сети клеток, которые вовлекаются в формирование памяти.
В последние несколько лет мы занимаемся совсем новым направлением - изучением работы мозга у генетически модифицированных животных. Это даст возможность получить предельно полную картину того, как генетически обеспечивается развитие головного мозга.»
К.В. Анохин. Из главы «Психофизиология и молекулярная генетика мозга» в руководстве по основам психофизиологии (Под. ред. Ю.И.Александрова)
1. Мозг – орган, экспрессирующий наибольшее число генов организме. На молекулярном уровне специфичность каждой из клеток организма создается составом белков, из которых она построена и которые обеспечивают ее функции. Эти белки синтезируются за счет активности генов в составе ДНК, содержащейся в ядре клетки - в геноме организма. Синтез белка посредством считывания информации с гена в виде молекулы матричной РНК (мРНК) и ее трансляции в белковую молекулу называется экспрессией гена. В каждой клетке экспрессируются далеко не все гены, а только определенная их часть, которая и определяет молекулярную специфику ее композиции и функций. Обычно, для построения того или иного органа достаточно экспрессии в его клетках лишь нескольких процентов от общего числа генов в геноме.
Один из важнейших фактов, обнаруженный молекулярной генетикой мозга, состоит в том, что число генов, активных в мозге млекопитающих, значительно превосходит количество генов, экспрессирующихся во всех других органах и тканях. Еще первые работы по оценке сложности состава мРНК в мозге мышей установили, что она огромна и приближается почти к 120 млн. нуклеотидов, по сравнению, к примеру, с приблизительно 30 млн. нуклеотидов в мРНК печени и почки. Позже, методами молекулярного клонирования удалось вычислить, что из приблизительно 80-100 тыс. генов составляющих геном крысы, около 50-60 тыс. экспрессируются в мозге, причем экспрессия более половины из них мозгоспецифична. Это в несколько раз превышало число генов, активных в печени, почках, селезенке или сердце. В действительности, молекулярный репертуар мозга может быть даже еще больше. Продукты многих мозгоспецифических генов подвержены альтернативному сплайсингу - экспрессия гена в разных клетках может давать различные белки за счет использования разной комбинации функциональных блоков одного и того же гена.
Человеческий мозг подчиняется такой же закономерности. Анализ тканеспецифичности экспрессии случайным образом выбранных 2505 генов из кДНК библиотеки мозга человека показал, что половина исследованных генов имеет мозгоспецифическую экспрессию. Этот расчет находит независимое подтверждение, происходящее из медицинской генетики. Приблизительно 50% из реестра генетических заболеваний человека содержат те или иные симптомы нарушений функций нервной системы. Таким образом, и у человека как минимум каждый второй ген связан с обеспечением той или иной функции нервной системы.
Значение этого факта состоит в том, что он заставляет серьезным образом пересмотреть представления о роли и месте нервной системы в эволюционной истории организмов.
2. Эволюция генома млекопитающих в значительной степени обеспечивала эволюцию мозга. Процесс эволюции организмов можно оценивать различным образом. Традиционные морфологические способы, использующиеся еще с конца 18 века, основаны на изучении трансформации строения органов и тканей. Однако, анатомические критерии не позволяют учесть все сложные эволюционные преобразования, часто выражающиеся в изменении строения и функций белков, ферментов, гормонов, рецепторов, детальных связей между клетками. Все это - события, не меняющие макроанатомию, но кардинальным образом влияющие на процессы интеграции и, в конечном счете, выживание организмов. Гораздо более чувствительным для учета подобных эволюционных изменений оказывается молекулярно-генетический анализ. Каждая сохраненная отбором модификация строения и функций гена, каждое появление в клетке или органе нового стабильно экспрессирующегося гена, свидетельствуют об отдельном эволюционном событии, общая сумма которых и отражает процесс проходившей эволюции.
Рассчитав с помощью такого подхода количество экспрессирующихся в органе генов, мы можем вычислить общий объем «усилий» эволюции, затраченных на его создание. Такие расчеты приводят к поразительному выводу. Из них следует, что эволюция генома млекопитающих в значительной мере выполняла задачу генетического обеспечения организации и функций мозга.
Этот факт придает совершенно неожиданный оборот мысли известного палеонтолога и философа Тейара де Шардена, что “история жизни есть, по существу, развитие сознания, завуалированное морфологией”. Очевидно, что еще до наступления эпохи молекулярной биологии, Шардену удалось интуитивно заметить одну из основных тенденций генетической эволюции – ее связь с эволюцией функций нервной системы.
Объяснение этого “молекулярно-генетического феномена мозга” становится сегодня одной из центральных задач нейронауки. Она сводится к необходимости ответить на вопрос: посредством каких из своих свойств нервная система определяла “нейроэволюцию” - эволюцию генома в сторону накопления генов, экспрессирующихся в мозге?
Решение этого вопроса зависит от понимания функций генов в процессах естественного отбора.
3. Проблема нейроэволюции связывает биологию с психологией. Естественный отбор, действующий на популяции организмов, приводит к размножению тех особей, которые имеют преимущества по тем или иным показателям приспособленности. Измененная отбором популяция имеет и измененные пропорции генов, которые были связаны с признаками, попавшими под действие естественного отбора. В связи с этим, для анализа процессов эволюции в современной эволюционной биологии используют показатель относительного изменения частот генов в популяции.
Однако естественный отбор не действует непосредственно на уровне генов. Он происходит на уровне целостных организмов (фенотипов) и их взаимоотношений со средой. Именно в ходе естественного отбора, который действует на функции и структуры, увеличивающие выживаемость или размножение, происходят популяционные изменения частот генов, связанных с этими функциональными системами. Поэтому для понимания механизмов эволюционных преобразований функций генов необходим свод “трансформационных правил”, который бы связывал изменения в “пространстве генотипов” с изменениями в “пространстве фенотипов”.
С помощью очень ясного графического анализа известный американский генетик Ричард Левонтин продемонстрировал, что для соотнесения частот генов с реальным процессом естественного отбора требуется набор из минимум четырех таких трансформационных правил. Первое (Т1) связывает зиготы (G1), через процессы эмбрионального развития, с теми признаками организма, которые несут селективные преимущества. Второе (Т2) определяет преобразования зрелых фенотипов на протяжении индивидуальной жизни и связано с экологическими взаимодействиями в процессе борьбы за существование, спаривания и естественного отбора. Третье (Т3) соотносит фенотипы с образованием половых клеток, законами рекомбинации и другими зависимостями, проецирующими фенотипы на генотипы. Наконец четвертое (Т4) описывает формирование новых зигот (G1) и определяется правилами сортировки генов, такими как законы Менделя и закон Харди-Вайнберга, позволяющими, исходя из родительских генотипов, предсказывать генотипы следующего поколения.
Таким образом, данный набор правил трансформации образует своеобразный “эволюционный цикл”.
Для нас в этом цикле особенно важны две фазы - Т1 и Т2. На первой из них происходит развитие функциональных структур организма, обеспечивающих выживание и размножение, а на второй – использование этих структур в ходе естественного отбора. У организмов с высокоразвитой нервной системой фаза Т2 тесно связана с механизмами адаптивной модификации сложившихся в развитии функциональных систем или формирования новых, то есть с процессами индивидуального обучения. Где-то среди роли этих процессов в естественном отборе и следует искать решение проблемы нейроэволюции – ответ на вопрос, почему в нервной системе наблюдалась такая концентрация эволюционных генетических изменений?
Особенность анализа этой проблемы в терминах эволюционного цикла состоит в том, что он помещает ее в контекст более широкого круга биологических вопросов. Действительно, любой орган и его функции, возникшие в ходе биологической эволюции, должны были создаваться внутри этого цикла. Поэтому, чтобы понять психику, как функцию определенной динамической организации структур мозга, следует понять как эти структуры и их организация возникли в ходе биологической эволюции. Это составляет часть проблемы морфологической эволюции - одной из центральных нерешенных проблем современной биологии. Ее решение, в свою очередь требует теории эволюции эмбрионального развития, теории описывающей процессы создания новых структур в организме. А решение этой проблемы не может быть полным, если не включить в нее описание механизмов отбора этих структур в процессах, определяемых поведением и психикой.
Следовательно, мы оказываемся в своего рода «циркулярной ловушке», выход из которой возможен только при одновременном решении всех составляющих ее вопросов. Поэтому проблема происхождения и адаптивных функций психики и проблема нейроэволюции перестают быть предметом только психологии и наук о мозге. Для решения проблемы нейроэволюции требуется единая теория, связывающая эмбриологию, морфологию, физиологию и психологию. Исследования, учитывающие факт нейроэволюции, обязаны показать, как поведение вписывает новую морфологию, возникающую при генетически измененном развитии мозга, в процессы адаптации, оцениваемые на весах естественного отбора. Они должны также ответить на вопрос, как две фазы эволюционного цикла - обучение и развитие - связаны с генами и регуляцией их экспрессии в мозге.
Мы находимся только на самых начальных подступах к этой проблеме. Однако уже сегодня мы можем определить основные направления ее решения.
Ясно, что в эволюции мозга, как и других органов тела, критическую роль играли регуляторные гены, определяющие процессы эмбрионального развития. Приобретение ими функций в нервной системе должно было происходить под контролем естественного отбора, дающие увеличение преимущества в выживании и/или размножении. Эти функции могли осуществляться на двух фазах эволюционного цикла. Одна из них – формирования инстинктивного «врожденного» поведения. Но, в отличие от других соматических органов, в мозге многие из этих генов вновь активируются и после завершения созревания – в ситуациях новизны и обучения.
Таким образом, в отношении мозга две фазы эволюционного цикла – созревание и адаптивные модификации функциональных систем, обеспечивающих выживание, оказываются тесно связанными на уровне механизмов регуляции экспрессии генов (рис. 2). По сути дела в мозге процессы морфогенеза и развития никогда не прекращаются, а лишь переходят под контроль когнитивных процессов.
Такое сходство заставляет думать об интенсивных эволюционных взаимодействиях и переходах между двумя этими доменами. Есть основания полагать что именно при исследовании этих взаимодействий может быть получен ответ на один из наиболее сложных и захватывающих вопросов современной науки – как в ходе филогенеза мозг стал органом, определяющим эволюцию генома?
4. Формирование нового опыта требует экспрессии генов в мозге. Современные представления о молекулярно-биологических механизмах обучения и памяти строятся на положении о кратковременной и долговременной формах хранения информации в мозге. В основе этой теории лежит открытие Г. Мюллера и А. Пильзекера, обнаруживших в 1900 году, что переход из кратковременной и легко нарушаемой памяти в долговременную и устойчивую память происходит у человека в течение первого часа после получения им новой информации. Они назвали этот процесс консолидацией памяти.
Основным шагом в понимании биологических механизмов консолидации памяти стало открытие 1960-х годов, показавшее, что переход памяти из кратковременной в долговременную форму требует синтеза новых молекул РНК и белка, т.е. экспрессии генов. Было установлено, что волна синтеза новых белков в клетках при запоминании информации совпадает с периодом консолидации памяти, обнаруженным Мюллером и Пильзекером, а химическая блокада экспрессии генов в этот период нарушает образование долговременной памяти. Оказалось также, что "критическое окно" амнестического действия блокаторов экспрессии генов универсально для самых разных видов обучения и различных организмов, от беспозвоночных до человека. Данное предположение также хорошо согласовывалось с гипотезой об участии клеточного роста и изменения морфологии синапсов в долговременной памяти.
Таким образом, понятие долговременной памяти постепенно трансформировалось из условного обозначения относительной продолжительности явления, в компонент биологической концепции, связывающей научение и опыт с морфогенезом и развитием. Критическим звеном этой концепции стал молекулярный механизм консолидации памяти, отождествляемый с активацией транскрипции генов в нервных клетках при научении. Однако то, какие именно гены активируются при научении и каковы их функции в нервных клетках, долгое время оставалось неизвестным.
5. При научении в мозге активируются гены транскрипционных факторов. Первыми генами, активация которых была обнаружена в мозге при обучении, оказались так называемые "непосредственные ранние гены", кодирующие транскрипционные факторы. "Непосредственные ранние гены" были впервые обнаружены при изучении механизмов геномного ответа на действие факторов роста, запускающих процессы клеточного цикла. Индукция их транскрипции происходила несмотря на подведение ингибиторов синтеза белка, то есть строилась на механизмах, заранее готовых для восприятия экстраклеточных стимулов. Первые из идентифицированных продуктов генов данного семейства оказались ядерными белками, связывающимися с ДНК и регулирующими транскрипцию других генов.
По этим свойствам данные гены значительно напоминали группу "непосредственных ранних генов" бактериофагов и эукариотических ДНК-вирусов, поэтому, по аналогии с вирусными генами, эта группа быстро активирующихся генов получила название "клеточных непосредственных ранних генов". Это же семейство часто обозначается как "гены первичного ответа", "гены раннего ответа" или просто "ранние" гены.
Одним из первых в данной группе был клонирован ген c-fos. Его структура и свойства хорошо изучены, и он может служить прототипом генов данного семейства. Первоначально было установлено, что в ходе эмбрионального развития c-fos играет важную роль в регуляции процессов клеточного роста и пролиферации. Гены, экспрессия которых находится под контролем индуцируемых транскрипционных факторов, были названы, по аналогии с вирусными системами, "поздними" генами, "генами позднего ответа" или "эффекторными" генами, а весь двухфазный механизм регуляции транскрипции с участием этих двух классов генов является одним из наиболее универсальных способов обеспечения процессов клеточного деления и роста в развитии.
В середине 1980-х годов несколько исследовательских групп обнаружили экспрессию гена c-fos в мозге обучающихся взрослых животных. Прямое подтверждение критической роли экспрессии гена c-fos в формировании памяти дали эксперименты с избирательной блокадой его активности мозге. Эти опыты показали, что подавление трансляции мРНК c-fos в структурах мозга нарушает долговременную, но не кратковременную память в различных моделях обучения и у разных видов животных.
Сходные данные были получены и для других членов семейства непосредственных ранних генов. Общее же число кандидатных генов пластичности, индуцируемых в нервной системе, по некоторым оценкам, может составлять до 1000.
6. На молекулярно-генетическом уровне научение составляет с развитием единый континуум. Таким образом, при научении в нервных клетках наблюдается следующая последовательность молекулярно-генетических процессов. Вначале рассогласование текущей ситуации с имеющимся опытом запускают активацию каскада "ранних" регуляторных генов в группах клеток опосредующих эти процессы. Продукты "ранних" генов индуцируют, в свою очередь, экспрессию "поздних" генов, в том числе генов морфорегуляторных молекул, являющихся ключевыми участниками процессов морфогенеза при эмбриональном развитии. Эти и другие эффекторные гены стабилизируют участие нейронов в новой, сложившейся в результата обучения, функциональной системе. При этом основные молекулярно-генетические элементы и этапы молекулярного каскада дифференцировки клетки оказываются чрезвычайно сходными при научении и развитии. В определенном смысле мы можем сказать, что на молекулярном уровне научение выступает как непрекращающийся процесс развития. Однако механизмы регуляции экспрессии генов при научении имеют одно чрезвычайно важное отличие от сходных процессов в развитии.
7. На системном уровне активность генов в мозге при научении переходит под когнитивный контроль. Выше уже упоминалось, что вопрос о том, вызовет или нет какая-либо поведенческая ситуация экспрессию "ранних" генов в клетках мозга, критическим образом зависит от содержания прошлого индивидуального опыта животного и определяется фактором субъективной новизны данного события. Это хорошо видно из следующего эксперимента.
Мышей помещали в камеру, где они получали серию неизбегаемых электрокожных раздражений. Это вызывало у них массивную активацию экспрессии гена c-fos в ряде структур головного мозга - коре, гиппокампе и мозжечке. Однако, после того как животных регулярно подвергали этому воздействию на протяжении 6 дней, в конце концов та же самая процедура, связанная с аверсивной стимуляцией, переставала вызывать активацию c-fos в клетках мозга. Хотя животные продолжали подвергаться электрокожному раздражению, это воздействие утеряло свою новизну и перешло в категорию ожидаемых событий в системах их индивидуального опыта. Таким образом, экспрессия c-fos в данных условиях вызывается вовсе не внешними стимулами, действующими на мозг, а их несоответствием материалу инидивидуальной памяти. Наиболее демонстративно это можно было увидеть на животных специальной группы, которым наносили раздражение на протяжении пяти дней, а на шестой день помещали их в ту же камеру, но электрокожную стимуляцию они в ней не получали. Это отсутствие стимуляции вызывало на первый взгляд парадоксальный эффект - животные данной группы демонстрировали значительную активацию экспрессии гена с-fos в мозге, особенно в гиппокампе.
Следовательно, взаимоотношение процессов развития нервной системы и научения требует описания на двух различных уровнях. На уровне регуляции экспрессии генов научение действительно составляет с развитием мозга единый континуум. В обоих случаях дифференцировка нервных клеток зависит от активации в них определенных транскрипционных факторов. Некоторые из этих белков кодируются семейством "ранних" генов. Активация этих генов и в развивающемся и обучающемся мозге осуществляется посредством факторов роста, медиаторов и гормонов. Вслед за экспрессией транскрипционных факторов наступает вторая волна активации "поздних" или эффекторных генов.
Белковые продукты этих генов, выполняют разнообразные функции в нервных клетках. В частности, молекулы клеточной адгезии и другие синаптические белки изменяют связи нейрона, устанавливая функциональную специализацию клетки в системе межклеточных отношений. Сходство молекулярных механизмов клеточной специализации на границе между завершающими стадиями созревания нервных связей и началом их модификации в поведении настолько велико, что, пользуясь одними лишь критериями молекулярного анализа, часто невозможно определить, относится ли рассматриваемый клеточный процесс к развитию или к научению.
Однако демаркация между процессами развития и научения отчетливо выявляется при системном анализе проблемы. Если на уровне молекулярных механизмов регуляции транскрипции, научение действительно выступает как продолжающийся процесс развития, то на системном уровне, управление этим клеточным процессом претерпевает фундаментальную трансформацию. Оно переходит из под контроля только локальных клеточных и молекулярных взаимодействий под контроль и более высокого порядка - общемозговых интегративных процессов, которые протекают в функциональных системах, составляющих индивидуальный опыт организма.
8. Мозг, психика и эволюция генома: на пути к теории нейроэволюции. Сегодня мы находимся только на самых начальных подступах к проблеме нейроэволюции. Однако мы уже можем определить основные направления ее решения.
Ясно, что в эволюции мозга, как и других органов тела, критическую роль играли регуляторные гены, определяющие процессы эмбрионального развития. По-видимому, к таким генам относятся, прежде всего гены различных транскрипционных факторов и морфорегуляторных молекул. Приобретение ими функций в нервной системе должно было происходить под контролем естественного отбора, дающие увеличение преимущества в выживании и/или размножении. Эти функции могли осуществляться на двух фазах эволюционного цикла. Одна из них - формирования инстинктивного "врожденного" поведения. Но, в отличие от других соматических органов, в мозге многие из этих генов вновь активируются и после завершения созревания - в ситуациях новизны и обучения.
Таким образом, в отношении мозга две фазы эволюционного цикла - созревание и адаптивные модификации функциональных систем, обеспечивающих выживание, оказываются тесно связанными на уровне механизмов регуляции экспрессии генов. По сути дела в мозге процессы морфогенеза и развития никогда не прекращаются, а лишь переходят под контроль когнитивных процессов. Такое сходство заставляет думать об интенсивных эволюционных взаимодействиях и переходах между двумя этими доменами. Есть основания полагать что именно при исследовании этих взаимодействий может быть получен ответ на один из наиболее сложных и захватывающих вопросов современной науки - как в ходе филогенеза мозг стал органом, определяющим эволюцию генома?
Библиография
Анохин К.В. Обучение и память в молекулярно-генетической перспективе//Двенадцатые Сеченовские чтения. М., 1996.
Анохин К.В. Психофизиология и молекулярная генетика мозга/Основы психофизиологии/Под. ред. Ю.И.Александрова. СПб., 2001.
Шмальгаузен И.И. Пути и закономерности эволюционного процесса. М., 1983.
Deacon T.W. The Symbolic Species: The Co-Evolution of Language and the Brain. N.Y., 1997.
Edelman G. The Remembered Present: A Biological Theory of Consciousness. N.Y., 1989.
Edelman G. Bright Air, Brilliant Fire. On the Matter of the Mind. N.Y., 1992.
Gould S.J. Ontogeny and Phylogeny. Harvard, 1977.
Pinker S. How the Mind Works. N.Y.; London, 1999.
Plotkin H. Evolution in Mind. An Introduction to Evolutionary Psychology. London, 1997.
Popper K.P. Knowledge and the Body-Mind Problem. London, 1994.
Wilson E.O. Consilience. N.Y., 1998.
Материал взят из архивов программы А. Гордона с сайта http://promo.ntv.ru/programs/specials/gordon/index.jsp?part=Article&pn=21&arid=8295
в начало
От модулятора к медиатору: быстрое действие BDNF на ионные каналы
Нейротрофины – семейство структурно связанных, секретируемых белков, регулирующих выживание, дифференцировку и поддержание функций различных популяций периферических и центральных нейронов.
Члены этого семейства белков характеризуются гомологией строения. К этому семейству относятся BDNF (мозговой нейротрофический фактор), NGF(фактор роста семейства нейротрофинов), NT-3, NT-4/5. Ряд членов данного белкового семейства был обнаружен у костных рыб, миног, амфибий, рептилий, и млекопитающих. Поиск других молекул со схожими последовательностями привел к обнаружению новых нейротрофинов у костных рыб и миног, тогда как не было выявлено гомологов нейротрофинов у беспозвоночных. Нейротрофины образуются из пре-про-нейротрофиновых предшественников, которые соответствующе изменяются и секретируются во внешнюю клеточную среду в виде зрелых гомодимерных белков.

BDNF связывается с двумя структурно не связанными между собой типами мембранных рецепторов: p75 и тирозинкиназным рецептором TrkB. TrkB также связывается с нейротрофином NT-4/5 с несколько меньшей аффинностью, чем с BDNF. NGF и NT-3 соответственно активируют тирозинкиназные рецепторы TrkA и TrkC.
BDNF, как член семейства нейротрофинов, также способствует выживанию нейронов. Этот нейротрофин и его рецепторы оказывают широкое влияние на центральную нервную систему (их экспрессия наиболее выражена в гиппокампе и коре больших полушарий).
Изначально BDNF выделяли из мозга свиньи, основываясь на его способности поддерживать выживание субпопуляции клеток базальных ганглиев. Позднее было продемонстрировано, что BDNF и его рецепторы также широко экспрессируются в центральной нервной системе. Особенно высокий уровень экспрессии был обнаружен в областях как развивающейся, так и свойственной взрослым синаптической пластичности, таких, как гиппокамп и кора головного мозга. Другим интересным свойством BDNF является то, что как его экспрессия, так и его секреция строго регулируются при развитии при нейрональной активности.
Более того, последние исследования показывают, что не только зрелый белок, но также и его предшественник «proBDNF» секретируются по-разному в зависимости от уровня активности. Несмотря на то, что ряд гипотез предполагает конститутивное освобождение BDNF, в настоящее время нет ясных свидетельств «действительно» конститутивного освобождения BDNF при физиологических условиях. В отличие от BDNF, ясная взаимосвязь между нейрональной активностью и экспрессией и секрецией NGF, NT-3 или NT-4/5 все еще не установлена. Таким образом, BDNF предстает в качестве основного кандидата для преобразования нейрональной активности в морфологическую и функциональную перестройку и поддержки нейрональных циклов.
Вдобавок к его традиционным нейротрофиновым эффектам, которые проявляются в течение часов или дней и обычно являются следствиями изменений экспрессии генов клетки, BDNF значительно влияет на синаптическую передачу и вовлечен в возникновение долговременной потенциации. Многие из этих быстрых эффектов BDNF обусловлены модуляцией им свойств ионных каналов, сопровождаемой TrkB-опосредованной активацией внутриклеточных каскадов вторичных посредников и фосфорилированием белков. Однако последние исследования показали, что BDNF действует не только как модулятор ионных каналов, но способен также сразу и быстро открывать натриевый канал, присвоив, тем самым, BDNF свойства классического возбудительного трансмиттера. Таким образом, BDNF, вдобавок к роли сильного нейромодулятора, предстает еще и как вещество, подобное возбудительному трансмиттеру, которое оказывает значительное влияние на мембранный потенциал покоя, нейрональную возбудимость, синаптическую передачу и принимает участие в образовании синаптической пластичности.
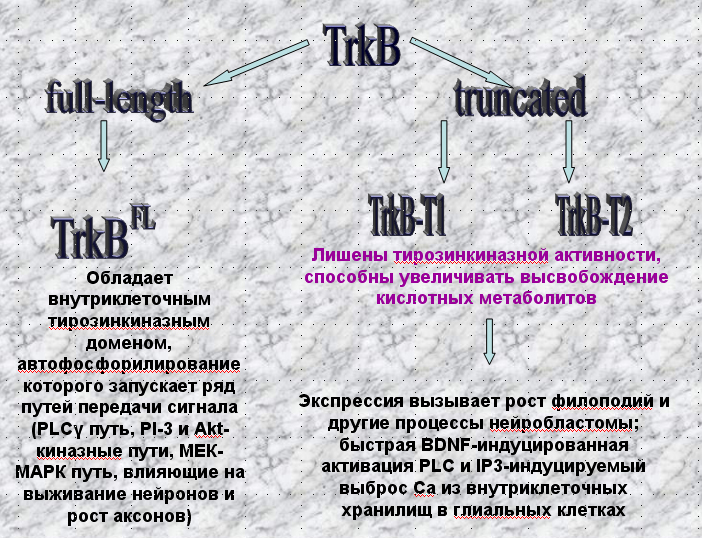
TrkB, рецептор, связывающийся с BDNF с наибольшей аффинностью, может экспрессироваться в нескольких вариантах. TrB FL обладает наиболее полной последовательностью, у него есть внутриклеточный тирозинкиназный домен. Укороченные вариации рецептора TrkB-T1 и TrkB-T2 не обладают тирозинкиназной активностью, однако участвуют в передаче сигнала в клетке. Их активация увеличивает высвобождение кислотных метаболитов. TrkB-T1 вызывает рост филоподий влияет на развитие нейробластомы. Через этот рецептор осуществляется быстрая активация PLC и IP3-вызванный выброс Са из внутриклеточных хранилищ в глиальных клетках.
Связывание BDNF с TrkB FL приводит к активации различных внутриклеточных сигнальных каскадов. Связывание с BDNF вызывает фосфорилирование нескольких тирозиновых остатков в цитоплазматическом домене рецептора. Автофосфорилирование запускает сигнальный путь фосфолипазы Су (PLCy). При этом образуются вторичные переносчики DAG диацилглицерол и инозитолтрифосфат IP3, выбрасывается из внутриклеточных ДЕПО Са. Стимуляция фосфорилирования PLCy происходит в течение 20 секунд после добавления BDNF в первичную культуру эмбрионных клеток мозга крысы и длится до 30 минут. Было показано, что Trk-опосредованная активация PLCy проявляется при долговременной потенциации в гиппокампе, вызванной тета-ритмом или тетанической стимуляцией, а также вызывает или индуцирует ионные токи.
Помимо PLCy активации TrkB FL фосфорилирование вызывает стимуляцию фосфолипид киназы PL-3 и Akt-киназы, которые играют главную роль в поддержке функций и выживании нейронов. В результате активируются малый GTF-связывающийся белок RAS и МЕК-МАРК сигнальный путь (митоген-активирующаяся протеинкиназа), вовлеченные в поддержание выживания неройнов и рост аксонов.
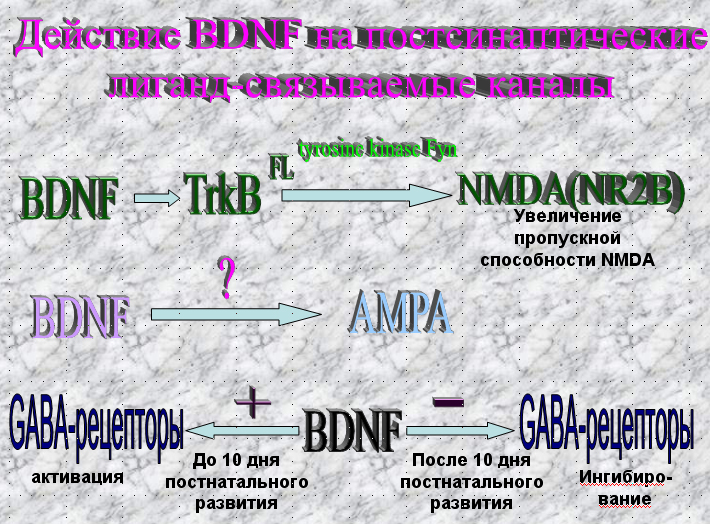
BDNF оказывает быстрый эффект как на возбудительную, так и на тормозную синаптическую передачу путем изменения свойств ионотропных рецепторов. В ряде исследований было показано, что BDNF непосредственно изменяет постсинаптические глутамат-связанные ионные каналы.
В частности, связывание BDNF с TrkB FL активирует данные постисинаптические рецепторы. Это, в свою очередь, увеличивает тирозиновое фосфорилирование NR2B, субъединицы NMDA-рецепторов и приводит к возрастанию пропускной способности последних (Са проходит внутрь клетки и служит вторичным посредником). Связывание TrkB FL рецепторов с NMDA рецепторами происходит с участием тирозинкиназы Fyn из Src-семейства тирозинкиназ. Было показано, что данные процессы задействованы при формировании пространственной памяти в гиппокампе. При введении блокатора тирозинкиназы К-252а в постсинаптический нейрон данные эффекты снимались, что еще раз подтверждает участие TrkB FL в активации NMDA с помощью нейротрофинов.
Было также выявлено быстрое увеличение пропускной способности NMDA рецепторов (время менее 1 сек) при использовании нейротрофинов, которое не блокировалось К-252а. Вызываемый BDNF ответ NMDA рецепторов находился в обратной зависимости от концентрации глицина. Предполагается, что нейротрофины действуют как глицин-подобные лиганды для NMDA рецепторов.
Спорным является действие BDNF на АМРА-рецепторы. Ранее не выявлялось каких-либо изменений в синаптической передаче, опосредованной этими рецепторами, под действием BDNF. Последние работы показали, с одной стороны, подавление пропускной способности АМРА-рецепторв (BDNF применялся в культуре нейронов гиппокампа), зависящее от тирозин киназной активности, что предполагает вовлечение TrkB FL. С другой стороны, ряд работ свидетельствует о том, что BDNF увеличивает поверхностную экспрессию АМРА-рецепторов и опосредованную ими передачу.
Действие BDNF на передачу, опосредованную GABA-рецепторами, двояко. Вплоть до 6 дня постнатального развития, пока GABA-рецепторы участвуют в процессах возбуждения, BDNF увеличивает постсинаптические GABA-опосредованные ответы через активацию TrkB FL и PLCy, что приводит к увеличению внутриклеточного Са (для этого необходима Са/кальмодулин-зависимая протеинкиназа 2 СаМК-2). На 14 день постнатального развития, когда GABA участвуют в торможении, применение BDNF уменьшает токи, обусловленные этими рецепторами, активируя те же пути передачи сигнала. Предполагается, что возможны 2 типа действия BDNF на GABA рецепторы: непосредственное изменение проводимости ионного канала, сопровождаемое увеличением внутриклеточного Са, или быстрое подавление BDNF постсинаптического транспорта Сl- в GABA-ергических токах и, следовательно, уменьшение ингибиторного действия тормозных ПСП.

Несколько подтипов К-каналов подвергаются тирозиновому фосфорилированию в результате действия BDNF. Например, Kv1.3, потенциал-зависимый ионный канал, участвует в образовании потенциала покоя нейронов и регуляции их возбудимости. Вызванная BDNF активация TrkB FL рецепторов увеличивает тирозиновое фосфорилирование Кв1.3 в течение 15 минут. Это подавляет выводящие токи всей клетки.
BDNF также влияет на активность G-белок-активируемых внутренних К-регулирующих каналов(Kir3). Это проявляется в длительной депрессии токов данных каналов после их тирозинового фосфорилирования под действием BDNF и деактивации Kir3.
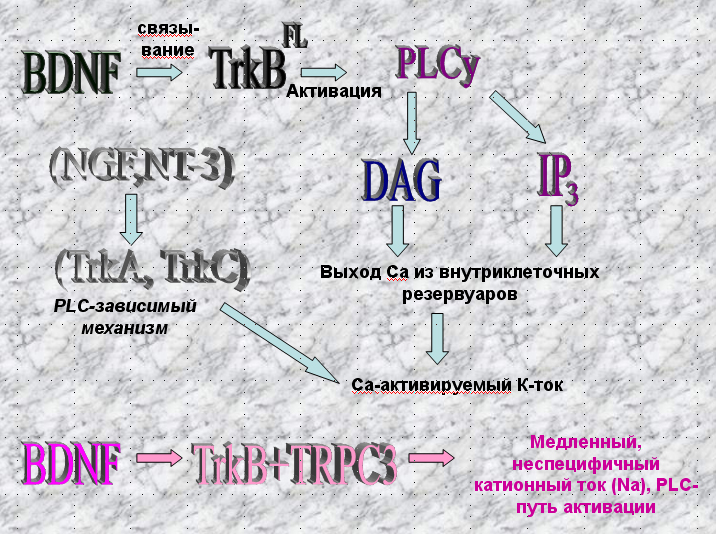
В нейронах мозга был также описан вызываемый BDNF, медленный неспецифический катионный ток, основной составляющей которого были катионы Na. Этот ток блокировался К-252а, что означает вовлеченность в его создание TrkB. Ток также блокировался ингибиторами PLC и IР3-рецепторов, что означает участие PLC-каскада в его индуцировании. Ряд экспериментов показал, что BDNF опосредованный ток по крайней мере частично обусловлен TRPC3 каналами (из семейства непотенциалзависимых, резервно-управляемых катионных каналов). Временное и пространственное распределение этих каналов параллельны таковым TrkB. Предполагается, что нейротрофины непосредственно соединяются с TRPC3- рецепторами через TrkB-рецепторы с образованием неспецифического притока катионов в центральных нейронах.
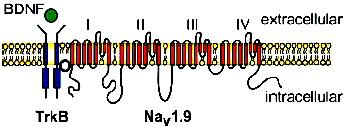
Вызванная нейротрофинами активация TrkB способна открывать ионные каналы в течение миллисекунд, что сравнимо с возбуждением нейронов, индуцируемым классическим возбудительным нейротрансмиттером глутаматом. В таком случае действие BDNF характеризует его как наиболее сильный нейротрансмиттер цнс. Подобные эффекты характерны для веществ, связывающихся с рецепторами мембраны, также являющимися ионными каналами (NMDA, AMPA). Однако ни один нейротрофиновый рецептор до сих пор не определен как классический ионотропный рецептор, включающий ионный канал. Тем не менее ряд исследований показал, что BDNF обусловливает быстрое открытие Na-специфичных ионных каналов. Данный эффект блокируется К252а, что указывает на участие TrkB FL-рецепторов в данном процессе. Скорость эффекта приводит к предположению о том, что TrkB FL прямо или косвенно, посредством адаптерной молекулы, взаимодействует с Na- специфическими каналами и обусловливает их открытие без дополнительных сигнальных путей.
Дальнейшие исследования показали, что в клетках нейробластомы BDNF вызывает быстрый приток Na ионов и обусловливает экспрессию разных изоформ Na каналов в системе. Возбуждение, вызываемое BDNF, блокируется низкими концентрациями сакситоксина STX (блокирует Na каналы), но требует для блокирования высокие концентрации тетродоттоксина TTX. Таким образом TTX-нечувствительный Nаv1.9 каналбыл выделен в качестве канала, обусловливающего ответ на BDNF. Данный канал принадлежит к семейству потенциал-зависимых каналов и экспрессируется в мозге повсеместно. В периферических сенсорных нейронах Nav1.9 обусловливает медленный, устойчивый, TTX- независимый потенциал-зависимый Na ток. В отсутствие TrkB рецепторов Nav1.9 требует экспрессии дополнительных субъединиц или регуляторных факторов, например, легкой цепи аннексина II. Присутствие данного фактора в сенсорных нейронах включает потенциал-зависимое открытие Nav1.9 и делает канал независимым от TrkB FL. Напротив, в центральных нейронах недостаток этого фактора переводит Nav1.9 в зависимость от TrkB FL, однако запал потенциала для активации канала через рецептор все равно требуется.
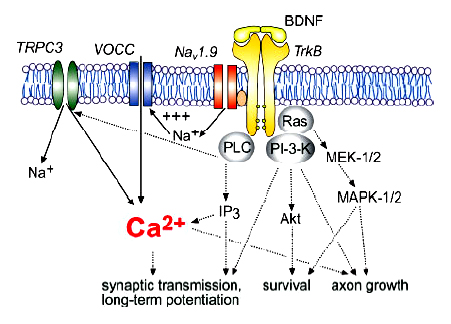
Итак, BDNF принимает непосредственное участи в формировании долговременного потенциирования. Ряд исследований показал, что BDNF увеличивает уровень постсинаптического Ca через активацию потенциал-зависимых Са каналов путем деполяризации мембраны. Вызываемый BDNF Na-ый ток представляет мощное средство для быстрого развития долговременной потенциации при введении нейротрофина. Раскрытие основ BDNF-индуцируемого Na –ого тока выявляет молекулярные основы быстрого и значительного вклада системы BDNF-TrkB в формирование долговременной потенциации.
BDNF вызывает быстрое возбуждение нейрона через систему TrkB-Nav1.9, обусловливающей значительное увеличение внутриклеточного Са из-за открытия потенциал-зависимых кальциевых каналов плазматической мембраны. Быстрый кальциевый сигнал ведет к активации СаМ-СаМ киназных путей передачи сигнала, активирует CREB и вызывает зависящую от нового уровня активности экспрессию генов и нейрональную пластичность. Кроме того, кальциевый сигнал активирует Ras-MAPK и Ras-PI3-киназный пути передачи сигнала.
Итак, в ряде работ показано, что активация TrkB при связывании с BDNF запускает ряд внутриклеточных сигнальных каскадов, в результате чего эффективно модулируются лиганд-зависимые, потенциал-зависимые и вызываемые с помощью вторичных переносчиков ионные токи за промежутки времени от секунд до минут. Более того, активация TrkB непосредственно открывает Na каналы в течение миллисекунд. Таким образом, BDNF предстает не только в качестве мощного нейромодулятора, но и в роли субстанции, оказывающей быстрое возбуждающее действие на нейроны. Это непосредственно влияет на возрастание мембранного потенциала, нейрональную возбудимость, синаптическую передачу и способствует проявлению синаптической и морфологическую пластичности нейронов.
Материал взят из статьи Rose C.R. at all, From modulator to mediator: rapid effects of BDNF on ion channels. Bioessays. 2004 Nov;26(11):1185-94.
в начало
|
|
|
|
